单羧酸转运蛋白(MCT)是一类负责乳酸、丙酮酸等关键代谢物跨膜运输的重要膜蛋白,其功能异常与肿瘤代谢重编程密切相关。部分MCTs定位在细胞膜上受到单次跨膜的伴侣蛋白Basigin或者embigin的调控。MCT1/2/4的高表达与肿瘤生长、转移及酸性微环境维持直接关联,已成为备受关注的潜在治疗靶点。然而,长期以来MCT与其辅助蛋白(Basigin, embigin)的互作机制、结构基础及高效特异性抑制剂的缺乏,严重制约了靶向MCT的抗肿瘤药物研发。
近日,天津大学医学部生命科学学院叶升/徐冰红课题组与西湖大学裴端卿课题组合作,在EMBO Reports杂志发表题为Structure-guided screening identifies Tucatinib as dual inhibitor for MCT1/2的研究论文。作者解析了MCT2-embigin在apo和抑制剂AR-C155858结合状态下的复合物结构,揭示了其调控底物转运的分子机制。基于结构进行药物库筛选,发现已上市药物Tucatinib能同时抑制MCT1和MCT2的转运功能,可有效阻断宫颈癌细胞的能量代谢,在实验和小鼠模型中显著抑制肿瘤生长与迁移,且安全性良好,为靶向肿瘤代谢疗法提供了新策略。

叶升课题组在2020年通过活细胞成像技术,发现人源单羧酸转运体2(MCT2)在转运丙酮酸时存在协同性(希尔系数n = 1.6)[1]。MCT2的协同转运机制对细胞具有重要的生理意义。为解释该机制,他们解析了第一个人源未结合底物状态的MCT2的高分辨结构,发现MCT2二聚体的一个亚基的TM1保守区域与另一个亚基的TM4-TM5连接的保守区域形成的氢键网络是MCT2存在转运协同性的结构基础。
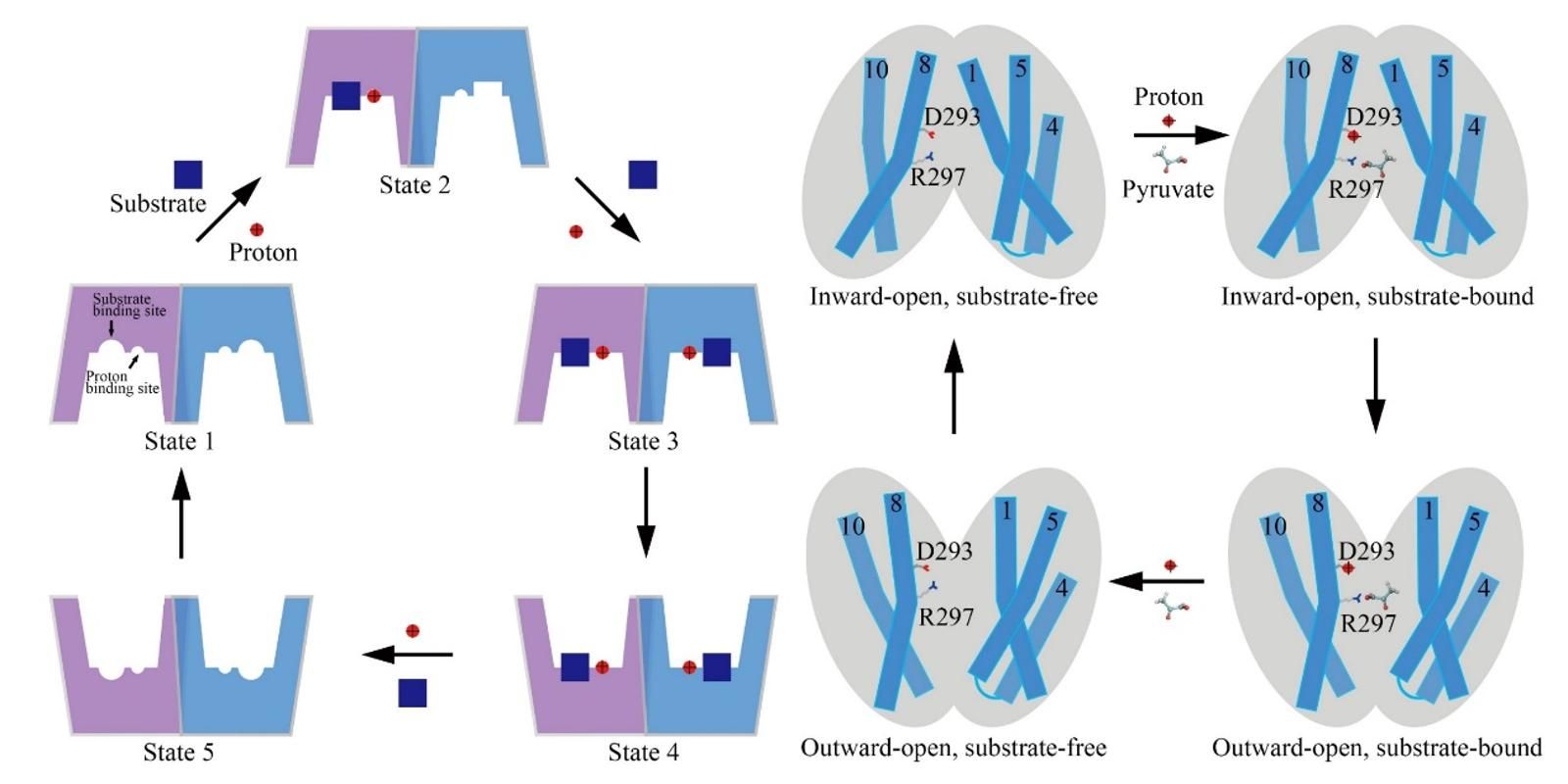
图1. MCT2的底物转运模型[2]
继解析MCT2结构之后,叶升/徐冰红课题组又解析了MCT1-embigin异源二聚体的3.6 Å冷冻电镜结构。该研究工作深入揭示了embigin 与MCT1 互作,协助其定位于质膜,引发MCT1 功能寡聚态改变及分子内部构象变化,从而调控底物转运活性的精确分子机制,是MCT 蛋白存在协同效应的有力佐证[2]。
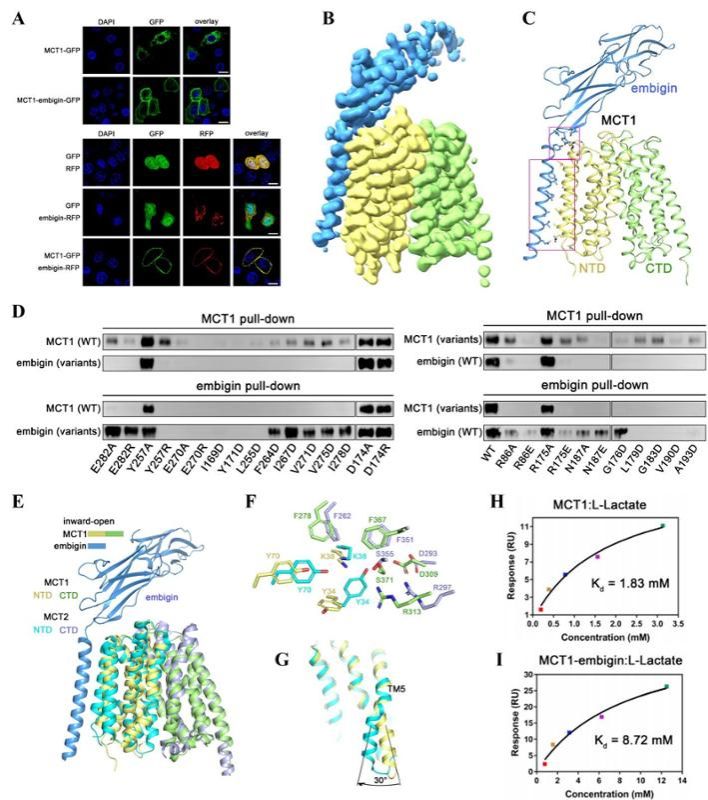
图2.MCT1的结构与功能研究
本篇文章的工作是对上述工作的进一步延续,作者通过冷冻电镜解析了人源MCT2-embigin复合物在apo状态及结合抑制剂AR-C155858下的高分辨率结构,首次揭示了embigin通过特异性互作促进MCT2膜定位及转运功能的分子机制。结构显示,MCT2呈现典型MFS超家族折叠,处于向外开放构象,形成面向胞外的底物结合腔。Embigin通过其单一跨膜螺旋与MCT2的TM6发生广泛疏水相互作用,并借助关键氢键与盐桥稳定复合物,从而促进MCT2向细胞膜的定位与转运功能。抑制剂AR-C155858结合在NTD与CTD形成的中央腔内,与保守残基Y34、F258、R297、F351等发生相互作用,其中R297与抑制剂形成关键氢键。通过结构比对与突变验证,该结合位点在MCT1/2中高度保守,这解释了AR-C155858能同时抑制MCT1与MCT2的原因,也为后续基于结构的药物筛选提供了精确的分子模板。
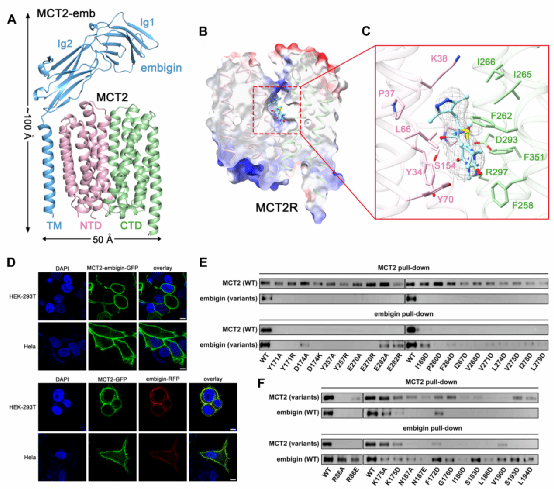
图3. MCT2-embigin 的结构与功能研究
基于MCT1/2结构进行虚拟筛选,作者发现已上市药物Tucatinib能高效抑制MCT1/2的底物转运。机制研究表明,Tucatinib占据并阻断MCT1/2的底物结合腔。在HER2低表达的宫颈癌细胞中,Tucatinib通过靶向MCT1/2显著抑制细胞增殖与迁移。小鼠移植瘤模型证实,Tucatinib可有效抑制肿瘤生长,且未表现出明显系统性毒性。Tucatinib作为MCT1/2抑制剂的全新作用机制,为宫颈癌治疗提供了新的靶向策略。
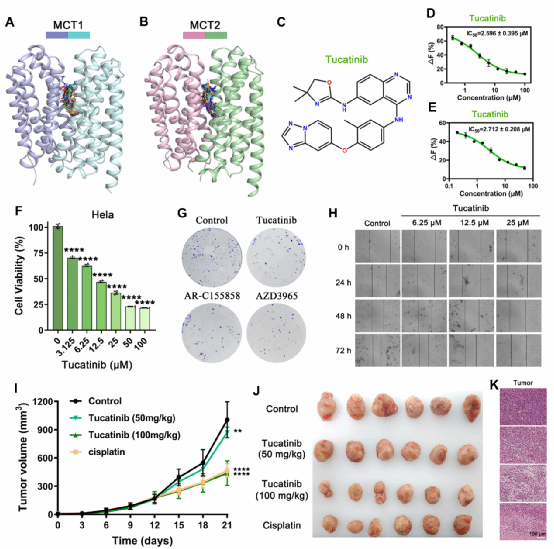
图4. Tucatinib通过靶向MCT1/2抑制宫颈癌发生发展
叶升/徐冰红课题组长期致力于单羧酸转运蛋白(MCT)结构与功能机制的系统研究,先后揭示了MCT2协同转运的结构基础与MCT1/2在异源伴侣蛋白调控下的构象变化,为理解其底物识别与转运机制提供了关键结构依据。近年来,课题组进一步将研究重心拓展至结构导向的药物研发,利用已解析的MCT靶点构象开展虚拟筛选与药效验证。他们先后发现中药活性成分水飞蓟宾(silybin)对MCT1具有抑制活性并展现出抗肝癌潜力[3],以及已上市药物Tucatinib可作为新型MCT1/2双重抑制剂,有效抑制宫颈癌细胞代谢与体内肿瘤生长。这些工作不仅深化了对MCT功能调控的认识,更推动其从基础结构研究向靶向药物发现的转化,为基于结构的抗代谢肿瘤治疗策略提供了连续且富有成效的研究范例。
天津大学医学部生命科学学院副研究员徐冰红为本文的第一兼共同通讯作者,天津大学医学部生命科学学院研究生周晓雨,西湖大学单圆月,河北医科大学副教授史赛,天津大学医学部生命科学学院研究生李嘉辰本文的共同第一作者。天津大学医学部生命科学学院叶升,西湖大学裴端卿,天津大学医学部生命科学学院王亚鑫,西湖大学章明峰为本文的共同通讯作者。该研究工作获得科技部、中国国家自然科学基金、天津市自然科学基金等经费资助。
原文链接
https://doi.org/10.1038/s44319-025-00661-9
参考文献
[1] Zhang B, Jin Q, Xu L, Li N, Meng Y, Chang S, Zheng X, Wang J, Chen Y, Neculai D, Gao N, Zhang X, Yang F, Guo J, Ye S. Cooperative transport mechanism of human monocarboxylate transporter 2. Nat Commun. 2020 May 15;11(1):2429. doi: 10.1038/s41467-020-16334-1.
[2] Xu B#, Zhang M#, Zhang B#, Chi W#, Ma X#, Zhang W, Dong M, Sheng L, Zhang Y, Jiao W, Shan Y, Chang W, Wang P, Wen S, Pei D, Chen L*, Zhang X*, Yan H*, Ye S*. Embigin facilitates monocarboxylate transporter 1 localization to the plasma membrane and transition to a decoupling state. Cell Rep. 2022 Sep 13;40(11):111343. doi: 10.1016/j.celrep.2022.111343.
[3] Shi S#, Li JC#, Zhou XY#, Li ZL*, Wang YX*, Xu BH*, Ye S*. Transport mechanism and drug discovery of human monocarboxylate transporter 1. Acta Pharmacol Sin. 2025 Mar 17. doi: 10.1038/s41401-025-01517-7.
